1. Οι γνωμοδοτήσεις της Επιτροπής Αξιολόγησης, που ενσωματώνουν τις εισηγήσεις της Επιτροπής Διαπραγμάτευσης, αποστέλλονται προς τον Υπουργό Υγείας, ο οποίος λαμβάνει την απόφαση περί ένταξης ή απένταξης ενός φαρμακευτικού προϊόντος από τον Κατάλογο Αποζημιούμενων Φαρμάκων του άρθρου 12 του ν.3816/2010 και περί αναθεώρησης του καταλόγου αυτού. Βάσει της ανωτέρω απόφασης, συντάσσεται ο αναθεωρημένος Κατάλογος Αποζημιούμενων Φαρμάκων και από την αρμόδια υπηρεσία του Υπουργείου Υγείας και αναρτάται στην ιστοσελίδα του Ε.Ο.Φ, μόνο για τη διόρθωση λαθών για χρονικό διάστημα τριών (3) ημερών. Ο Κάτοχος Άδειας Κυκλοφορίας υποβάλει έγγραφη αναφορά για τα τυχόν υφιστάμενα λάθη, και η διόρθωση των λαθών γίνεται από την Γραμματεία της Επιτροπής , η οποία και αποστέλλει τις διορθώσεις προς την αρμόδια υπηρεσία του Υπουργείου Υγείας, προκειμένου να εκδοθεί αναθεωρημένη απόφαση του Υπουργού Υγείας.
2. Η απόφαση του Υπουργού Υγείας περί ένταξης ενός φαρμακευτικού προϊόντος στον Κατάλογο Αποζημιούμενων Φαρμάκων του άρθρου 12 του ν.3816/2010, πρέπει να εκδοθεί και να κοινοποιηθεί με κάθε πρόσφορα μέσο προς τον αιτούντα Κάτοχο Άδειας Κυκλοφορίας, που τον αφορά, εντός αποκλειστικής προθεσμίας εκατόν ογδόντα (180) ημερών από την κατάθεση της αίτησης της παρ.1 του άρθρου 4 του παρόντος νόμου . Σε περίπτωση παρέλευσης της ανωτέρω προθεσμίας, η τυχόν αίτηση του ΚΑΚ τεκμαίρεται ότι έχει απορριφθεί σιωπηρώς. Όλες οι αποφάσεις του Υπουργού Υγείας, που λαμβάνονται ύστερα από γνώμη της Επιτροπής Αξιολόγησης αναρτώνται υποχρεωτικά στο διαδίκτυο, όπως προβλέπεται στον ν.3861/2010 (Α’ 112) και δημοσιεύονται στην Εφημερίδα της Κυβέρνησης. Δεν δημοσιεύεται η τιμή αποζημίωσης των φαρμακευτικών προϊόντων. Η ανάρτηση στο διαδίκτυο λογίζεται για την εφαρμογή της προθεσμίας του πρώτου εδαφίου της παρούσας παραγράφου, ως πρόσφορος τρόπος κοινοποίησης προς τον αιτούντα.
3. Η αποκλειστική προθεσμία της προηγούμενης παραγράφου αναστέλλεται για όσο χρονικό διάστημα ο Κάτοχος Άδειας Κυκλοφορίας: α) δεν καταβάλει το τέλος αξιολόγησης της παρ.1 του άρθρου 4 του παρόντος νόμου ή β) δεν προσκομίζει τα πληροφοριακά στοιχεία και τα έγγραφα που προβλέπονται από τον Εσωτερικό Κανονισμό Λειτουργίας της Επιτροπής. Μετά την παρέλευση 60 ημερών από την έγγραφη γνωστοποίηση προς τον ΚΑΚ των ανωτέρω παραλείψεών του, η σχετική αίτηση απορρίπτεται με απόφαση του Υπουργού Υγείας, ύστερα από γνώμη της Επιτροπής Αξιολόγησης.
4. Οι αποφάσεις του Υπουργού Υγείας περί ένταξης ή απένταξης φαρμακευτικών προϊόντων στον Κατάλογο Αποζημιούμενων Φαρμάκων του άρθρου 12 του ν.3816/2010 και περί αναθεώρησης του καταλόγου αυτού υποχρεωτικά δημοσιεύονται στην Εφημερίδα της Κυβέρνησης και ισχύουν από την ημερομηνία δημοσίευσής τους.
5. Οι αποφάσεις της προηγούμενης παραγράφου καθώς και η σιωπηρή απόρριψη της αιτήσεως της παρ.2 του παρόντος άρθρου προσβάλλονται με αίτηση ακύρωσης ενώπιον του Τριμελούς Διοικητικού Εφετείου, στην περιφέρεια του οποίου έχει την έδρα του ο αιτών ΚΑΚ, σύμφωνα με τις διατάξεις του π.δ.18/1989 (Α’8) και του ν.702/1977 (Α’268). Τα προβλεπόμενα ένδικα βοηθήματα και η προθεσμία άσκησης αυτών αναγράφονται υποχρεωτικά στην σχετική απόφαση του Υπουργού Υγείας.
6. Με απόφαση του Υπουργού Υγείας, μετά από πρόταση της Επιτροπής του άρθρου 15 της Υ.Α. οικ.3457/2014 (Β΄ 64), η οποία υποχρεωτικά ενσωματώνει τους συνταγογραφικούς περιορισμούς της Επιτροπής Αξιολόγησης, για μεμονωμένα φαρμακευτικά προϊόντα ή ομάδες φαρμακευτικών προϊόντων ή για φαρμακευτικά προϊόντα για τα οποία έχει τεθεί ετήσιος προϋπολογισμός φαρμακευτικής δαπάνης, σύμφωνα με την προηγούμενη παράγραφο του παρόντος άρθρου, εκδίδονται πρωτόκολλα συνταγογράφησης, η τήρηση των οποίων καθίσταται υποχρεωτική για την αποζημίωση των φαρμακευτικών αυτών προϊόντων και ενσωματώνονται στο σύστημα της ΗΔΙΚΑ Α.Ε.. Η ως άνω επιτροπή για την ανάπτυξη των πρωτοκόλλων συνταγογράφησης λαμβάνει υπόψη της επιστημονικά κριτήρια, συμπεριλαμβανομένων στοιχείων επιδημιολογικής συχνότητας (επιπολασμός και επίπτωση) και αναγκών κάλυψης σε νόσους και νοσηλείες, καθώς επίσης και οικονομικά κριτήρια, στα οποία συμπεριλαμβάνεται η δημοσιονομική επίπτωση της αποζημίωσης του φαρμακευτικού προϊόντος βάσει της τιμής αποζημίωσης, όπως εκάστοτε καθορίζεται. Με απόφαση του Υπουργού Υγείας καθορίζονται οι λεπτομέρειες της διαδικασίας ενσωμάτωσης των συνταγογραφικών περιορισμών και των πρωτοκόλλων συνταγογράφησης των προηγούμενων εδαφίων στο σύστημα της ΗΔΙΚΑ Α.Ε.



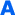


Παρ.2 : ….«Δεν δημοσιεύεται η τιμή αποζημίωσης των φαρμακευτικών προϊόντων»….
Το νομοσχέδιο προβλέπει ότι δεν θα δημοσιεύονται οι τιμές αποζημίωσης.
Αυτό για τα προϊόντα κοινότητας είναι ανέφικτο διότι με βάση την τιμή αποζημίωσης καθορίζονται οι συμμετοχές των ασθενών
Θεωρούμε απαράδεκτη την πρόβλεψη πρακτικής «σιωπηρής απόρριψης αίτησης» μετά την πάροδο 180 ημερών, χωρίς να υπάρξει αποστολή τεκμηριωμένης απάντησης στον αιτούντα. Αποτελεί πρακτική που δε συνάδει με τα ήθη και την πρακτική που ακολουθείται από ένα σοβαρό και υπεύθυνο οργανισμό, ενώ αποτελεί και στοιχείο που δείχνει συμπεριφορές απαξίωσης προς τον αιτούντα.
Αντίθετα η σχετική Οδηγία της Ευρ. Επιτροπής και η εφαρμογή από Ευρωπαικούς Οργανισμούς ΗΤΑ, όπως στην Ιταλία, προβλέπουν ότι αν εντός 180 ημερών δεν έχει λάβει ο αιτών απάντηση, το φαρμακο τιθεται σε κυκλοφορία.
§2: Η σιωπηρή απόρριψη της αίτησης των Κατόχων Άδειας Κυκλοφορίας (ΚΑΚ) σε περίπτωση παρέλευσης της αποκλειστικής προθεσμίας των 180 ημερών δεν ακολουθείται ως πρακτική από κανένα οργανισμό HTA στην EE. Για τη διασφάλιση της αρχής της διαφάνειας αιτούμεθα (α) τη γνωστοποίηση τελικής απόφασης (θετική ή αρνητική) του Υπουργού Υγείας προς τον Κάτοχο Άδειας Κυκλοφορίας (ΚΑΚ) με ειδική αιτιολόγηση, και (β) πρόβλεψη επίσημης διαδικασίας διαβούλευσης πριν τη γνωμοδότηση από την Επιτροπή Αξιολόγησης και Αποζημίωσης Φαρμακευτικών Προϊόντων Ανθρώπινης Χρήσης και ενστάσεων μετά τη γνωμοδότηση με σαφή και καθορισμένα χρονοδιαγράμματα προκειμένου να διασφαλιστεί η γρήγορη πρόσβαση των ασθενών σε καινοτόμες θεραπείες.
Παρατηρήσεις:
• Δεν δίνεται καμία δυνατότητα διαβούλευσης/ ακρόασης με τη φαρμακευτική βιομηχανία κατά τα διάφορα στάδια της αξιολόγησης, παρά μόνο η δυνατότητα έφεσης στην τελική απόφαση του Υπουργού Υγείας. Η διαδικασία της αξιολόγησης είναι μη διαφανής καθώς ο αιτών ΚΑΚ δεν έχει γνώση της προόδου της αξιολόγησης και είναι εκ διαμέτρου αντίθετη με το τι ισχύει σε αναγνωρισμένους οργανισμούς HTA οι οποίοι έχουν προκαθορισμένα βήματα διαβούλευσης, διαλόγου με σαφείς γραμμές επικοινωνίας μεταξύ της Επιτροπής και του ΚΑΚ
• Δεν νοείται σιωπηρή απόρριψη παρά μόνο σιωπηρή αποδοχή. Αυτό αντιβαίνει στην EU transparency directive που επιβάλει την κοινοποίηση αιτιολόγησης. Πρέπει να δίνεται γραπτή αιτιολόγηση της απόφασης. Να σημειωθεί στην περίπτωση αυτή πως ο αιτών ΚΑΚ έχει πληρώσει τέλος που αντιστοιχεί στα έξοδα της αξιολόγησης και δεν λαμβάνει ούτε καν ενημέρωση.
Προτάσεις:
1. Πρόβλεψη διαδικασίας διαβούλευσης/ ακρόασης και ενστάσεων σε όλα τα στάδια της διαδικασίας αξιολόγησης καθώς και στην τελική γνωμοδότηση πριν την υποβολή της στον Υπουργό όπως ισχύει στους οργανισμούς HTA διεθνώς
2. Άρση της σιωπηρής απόρριψης και αντικατάστασή της με σιωπηρή αποδοχή μετά την πάροδο των 180 ημερών
Τεκμηρίωση Α: https://www.nice.org.uk/media/default/about/who-we-are/nice_charter.pdf
How we involve people
22. All of our guidance, quality standards, and other products are developed taking into account the opinions and views of the people who will be affected by them, including patients, carers and members of the public, as well as health and social care professionals, NHS organisations, industry, social care businesses and local government.
23. Our consultation process allows a range of individuals and organisations to comment on our recommendations throughout the development of our guidance and quality standards. Our guidance is created by independent and unbiased advisory committees that include a diverse range of experts from surgeons and midwives, to health economists and social workers, as well as patients or carers or other members of the public.
Working with the healthcare industries
26. Much of what NICE does has an impact on the healthcare industries that supply the NHS. We are very conscious of the responsibility we carry when we advise the NHS on the use of health technologies and we know that what we say about new technologies is often taken into account in health systems beyond the United Kingdom. For these reasons we regard the relationship we have with industries and individual companies as having equal importance with our other stakeholders and we will continue to work with the industry associations in this country and abroad to build mutual respect and trust.
Τεκμηρίωση Β: Διάλογος, διαβούλευση, σαφή χρονοδιαγράμματα & γραμμές επικοινωνίας https://www.nice.org.uk/about/what-we-do/our-programmes/nice-guidance/nice-technology-appraisal-guidance/process/sta-timeline
Άρθρο 5 §2
Στο σχέδιο νόμου ορίζεται ότι σε περίπτωση παρέλευσης της ανωτέρω προθεσμίας, η τυχόν αίτηση του ΚΑΚ τεκμαίρεται ότι έχει απορριφθεί σιωπηρώς, όταν μάλλον θα περιμέναμε να τεκμαίρεται ότι έχει εγκριθεί σιωπηρώς! Αντιβαίνει σε κάθε περί δικαίου αίσθημα η λογική ότι επί απουσίας απάντησης (λόγω καθυστερήσεων από την Επιτροπή; λόγω τεχνικών δυσκολιών της Επιτροπής; λόγω νομικών κολλημάτων;) τεκμαίρεται άρνηση αποζημίωσης και όχι έγκριση. Μια απορριπτική απόφαση των οργάνων της Διοίκησης θα πρέπει, σε κάθε περίπτωση, να κοινοποιείται με κάθε πρόσφορο τρόπο στον ΚΑΚ και να αιτιολογείται πλήρως με κριτήρια επαληθεύσιμα και ως εκ τούτου αντικειμενικά. Πολλώ δε μάλλον, όταν τυχόν απόρριψη επιφέρει αδυναμία επανυποβολής αίτησης για 6 μήνες, καθυστερώντας υπέρμετρα την πρόσβαση των ασθενών στην καινοτομία που έχουν ανάγκη.
Αυτή η αντίθετη προσέγγιση έρχεται σε ευθεία αντίθεση στα οριζόμενα από την Κοινοτική Οδηγία περί Διαφάνειας 89/105, όπως τροποποιήθηκε και ισχύει, με την οποία έχει εναρμονιστεί και η Ελληνική νομοθεσία, αλλά και σε όσα ορίζονται στη §3 του ίδιου του άρθρου περί νέας αίτησης από την έκδοση της αρνητικής απόφασης.
Πέραν τούτου στην ίδια παράγραφο ορίζεται πως «Δεν δημοσιεύεται η τιμή αποζημίωση των φαρμακευτικών προϊόντων». Δεδομένου ότι προηγείται διαπραγμάτευση, ο όρος αυτός είναι αυτονόητος στο πλαίσιο της εμπιστευτικότητας και οφείλει να περιλαμβάνει την απαγόρευση οποιουδήποτε τύπου επίσημης αναφοράς στην τιμή αποζημίωσης (π.χ. αναφορά της τιμής στο πλαίσιο μιας πολιτικής συζήτησης) .
Τέλος, το άρθρο αυτό δεν ορίζει τον τρόπο υπολογισμού της συμμετοχής των ασθενών στη δαπάνη για τη θεραπεία τους. Προκειμένου να μπορεί να εκτιμηθεί και να συζητηθεί εμπεριστατωμένα τόσο η σκοπιμότητα όσο τελικά και η οικονομική αποδοτικότητα της προτεινόμενης διαδικασίας αποζημίωσης, δεδομένης της κατάργησης των διατάξεων για το σύστημα τιμών αναφοράς και την κατάρτιση της θετικής λίστας σε ATC κατηγοριοποίηση (άρθρο 10 §5), θα πρέπει άμεσα να διευκρινιστεί και εξεταστεί στο ίδιο, ενιαίο, πλαίσιο ο τρόπος συμμετοχής των ασθενών.
Άρθρο 5 §1
Η αναφορά του σχετικού άρθρου σε λήψη απόφασης για ένταξη η μη τελικώς από τον Υπουργό Υγείας έχουμε την πεποίθηση ότι περιορίζεται στην υπογραφή της σχετικής Υπουργικής Απόφασης και την ευθύνη έκδοσης του οικείου ΦΕΚ. Αυτό οφείλει να διευκρινιστεί στο κείμενο του σχεδίου νόμου. Διαφορετικά, θα περιγράφεται μια διαδικασία επιστημονικής τεκμηρίωσης μιας απόφασης αποζημίωσης φαρμακευτικού σκευάσματος με συγκεκριμένη και προσδιορισμένη επίπτωση στα δημόσια οικονομικά, η οποία υλοποιείται από υψηλής τεχνογνωσίας στελέχη, το αποτέλεσμα της οποίας όμως εκτίθεται στη διακριτική ευχέρεια του εκάστοτε Υπουργού και συνιστά απλώς εισερχόμενο σε μια πολιτική, πλέον, απόφαση. Η λογική αυτή υπονομεύει την ίδια την επιστημονική φύση αλλά και τη συνολική βαρύτητα και αξιοπιστία της διαδικασίας αξιολόγησης και εκθέτει το αποτέλεσμά της σε τυχόν αυθαίρετες παρεμβάσεις.